Ao selecionar o desinfetante ideal para salas limpas, há muitos critérios a serem considerados e é essencial um bom entendimento das características do produto.
Um desinfetante de sala limpa bem-sucedido precisa atender a muitos critérios, não apenas em termos de eficácia, mas também em termos de embalagem, facilidade de uso e aceitabilidade do operador. Muito foi escrito sobre como especificar e selecionar um desinfetante de sala limpa e, portanto, este artigo fornece uma breve visão geral dos requisitos que ajudarão na comparação de produtos químicos desinfetantes de cloro disponíveis.
Comprar cloro em São Paulo
A fabricante de produtos de limpeza Biosan vende desinfetantes a base de hipoclorito de cloro em São Paulo.
Tomando como uma boa eficácia de amplo espectro, incluindo esporos bacterianos altamente resistentes, os requisitos para o desinfetante ideal para salas limpas são bastante longos: uma opção estéril para ambientes de grau A e B; 1 não inflamável; portanto, pode ser usado em grandes áreas sem preocupações com saúde e segurança; também secagem rápida com curtos tempos de contato para reduzir o tempo necessário para a biodecontaminação. No entanto, em nosso mundo ideal, isso não pode ser trocado por problemas com equipamentos ou nossos operadores ou com o ambiente mais amplo em termos de descarte.
Outro requisito é que os processos de limpeza não deixem resíduos desinfetantes ou, no mínimo, resíduos de enxágue gratuitos. Isso ocorre porque nenhum resíduo significa que não há necessidade de remoção de resíduo e isso, por sua vez, pode encurtar o processo de descontaminação. O produto precisará ter um prazo de validade fechado de 12 meses e mais de três meses de validade em uso para ser prático para armazenar e usar. Esse desinfetante ideal precisaria ser fabricado de acordo com os requisitos do cGMP, ser notificado ao BPR 2 e fornecido em embalagens compatíveis com salas limpas em vários formatos, para que seja adequado para uso em todas as áreas da sala limpa.
Escusado será dizer que tudo isso precisa ser alcançado em uma formulação econômica. Muitas pessoas acreditam que esse esporicida ideal não existe e sempre deve ser feito um compromisso.
Em uma primeira reflexão, um desinfetante à base de cloro não passaria necessariamente à mente como o desinfetante que atende a todas essas necessidades ideais. O hipoclorito de sódio é o desinfetante de superfície à base de cloro mais utilizado, mas apresenta algumas desvantagens conhecidas, como: inativação na matéria orgânica; é corrosivo para alguns metais; e deixará um resíduo particulado. No entanto, todos os desinfetantes de cloro não são os mesmos. Os avanços nas metodologias de produção permitiram a criação de um desinfetante que atenda a todos os requisitos acima.
A história do cloro
Um dos primeiros usos conhecidos de cloro para desinfecção foi na forma de hipoclorito conhecido como cloreto de cal. Snow o usou em 1850 após um surto de cólera para tentar desinfetar o abastecimento de água da Broad Street Pump em Londres. Berthollet, em 1785, preparou um agente de branqueamento dissolvendo o “gás de Scheele” em água e em 1789 o aperfeiçoou misturando-o com uma solução de potássio cáustico (KOH). Isso foi realizado em uma fábrica química francesa em Javel e ainda hoje é conhecida como água de Javelle. Pouco tempo depois, o Labarraque substituiu o caro hidróxido de potássio por soda cáustica; esse desenvolvimento resultou no que provavelmente foi o primeiro uso do hipoclorito de sódio como alvejante.
O cloro começou a ser usado como desinfetante no final do século XIX até o início do século XX. Alvejante líquido – hipoclorito de sódio – foi amplamente utilizado na década de 1930 e hoje é o mais amplamente usado entre todos os alvejantes clorados. Soluções de hipoclorito foram usadas para o tratamento de feridas abertas durante a Primeira Guerra Mundial e levaram ao uso de geração local de hipoclorito em hospitais. Estes ficaram em desuso até os anos 90, que viram um grande aumento no interesse da geração local de cloro.
Esses geradores no local fornecem uma solução contendo apenas 0,8% de cloro, o que não é perigoso; no entanto, o gás hidrogênio perigoso é produzido como subproduto. A geração no local também é bastante ineficiente em comparação com a produção a granel e possui altos custos de eletricidade associados.
O hipoclorito de cálcio seco apareceu no mercado americano em 1928. Esse agente clareador contém até 70% de cloro ativo e também é conhecido como hipoclorito de alto teste. Está disponível em uma variedade de formas, incluindo pó, grânulos, briquetes e comprimidos.
Os sistemas de hipoclorito de cálcio tendem a ser usados para pequenas estações de tratamento de água e sistemas de poços. O hipoclorito de cálcio tem um potencial oxidante muito forte e, consequentemente, é muito perigoso para armazenar e usar. O hipoclorito de cálcio dissolvido em água gera 2 mols de ácido hipocloroso por cada 1 mole de hipoclorito de cálcio.
Cloro como desinfetante
Nem todas as espécies de cloro são igualmente eficazes como desinfetantes. Muitos estudos exploraram o mecanismo de desinfecção do cloro e, embora não seja possível explicar com precisão como cada espécie de cloro funciona, a teoria atual acredita que a inativação ocorre por meio de um ou mais dos seguintes mecanismos:
- inativação das principais enzimas;
- perturbação dos ácidos nucleicos, tornando-os não funcionais;
- e dano oxidativo às paredes celulares ou outros componentes celulares vitais.
Para cada um dos mecanismos descritos acima, a eficácia de cada agente desinfetante é uma função de sua taxa de difusão através da parede celular e de reatividade com a parede celular, proteínas e ácido nucleico.
O ácido hipocloroso (HOCL) é o desinfetante mais eficaz da família do cloro disponível em solução diluída. Sugere-se que o HOCL seja 80 a 120 vezes mais eficaz que o hipoclorito de sódio. Como o HOCL não tem carga e possui um peso molecular relativamente baixo, é mais capaz do que os outros desinfetantes à base de cloro de penetrar nas paredes das células. Também reage mais rapidamente do que outros desinfetantes à base de cloro a reações de oxidação com matéria orgânica, isto é, os componentes críticos das células microbianas.
Por outro lado, o íon hipoclorito é um desinfetante relativamente pobre devido à sua incapacidade de se difundir através da parede celular. Uma vez que é carregado negativamente, é repelido eletrostaticamente das paredes celulares, que também são carregadas negativamente. É muito maior em tamanho do que uma molécula HOCL, por isso também se difunde mais lentamente devido ao seu tamanho maior.
Química do cloro
O cloro é adicionado à água em uma de três formas: cloro elementar (gás de cloro), solução de hipoclorito de sódio ou pó de hipoclorito de cálcio (hipoclorito de alto teste). O gás cloro reage rapidamente com a água para formar dois compostos: ácido hipocloroso (HOCl) e ácido clorídrico (HCl).
| Cl 2 | + | H 2 O | ↔ | HOCl | + | HCl |
| Cloro | água | ácido hipocloroso | ácido clorídrico |
O ácido hipocloroso (HOCl) é um ácido fraco que se dissocia ainda mais no íon hipoclorito (OCl-) e no íon hidrogênio, de acordo com a seguinte equação:
HOCl → H + + OCl – (íon hipoclorito)
Essas três espécies existem em um equilíbrio que depende tanto do pH quanto da temperatura; a soma destes é denominada cloro total disponível. A 25 ° C e pH 7,5, metade do cloro total está presente como HOCl e a outra metade como OCl-. O íon hipoclorito dissociado (OCl-) predomina em valores mais altos de pH, acima de 7,5, enquanto o ácido hipocloroso não dissociado (HOCl) predomina em valores mais baixos de pH. No pH 5, quase todo o cloro está presente como HOCl, enquanto um valor de pH de 10 leva quase todo o cloro a estar presente como OCl- (veja a Figura 1). Em baixas concentrações e de pH elevado de cloro a hidrólise não é completo e permanece uma significativa fracção sob a forma de cloro molecular Cl 2.
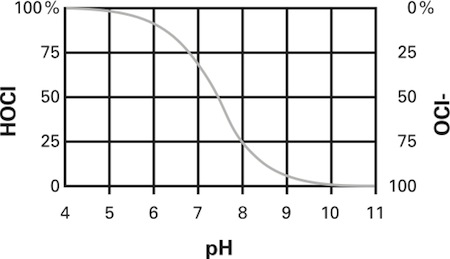
Em uma solução de hipoclorito de sódio que normalmente fica em um pH de 11 a 13, todo o cloro disponível está na forma de íons hipoclorito (OCl-) que, como discutido anteriormente, é muito menos eficaz que o ácido hipocloroso.
Até recentemente, não era possível criar ácido hipocloroso em uma solução estável com prazo de validade útil. O ácido hipocloroso gerado a partir da dissolução do hipoclorito de cálcio seco tem uma vida útil de aproximadamente quatro horas, portanto, não é adequado para uso em ambientes farmacêuticos ou de saúde.
Os avanços na química do cloro levaram uma empresa a estabilizar uma solução baseada no hipoclorito de cálcio, a um pH de 3,5 a 5,5, para que todo o cloro disponível seja na forma de ácido hipocloroso, com prazo de validade de 18 meses.
| Teste | Descrição | Redução de log | Tempo | Teste | Descrição | Redução de log | Tempo (min) |
| EN1276 | E.hirae | > log 7 | 1 minuto | EN13704 | C.sporogenes | > log 6 | 1 minuto |
| EN1276 | S. aureus | > log 7 | 1 minuto | EN13704 | C.difficile | > log 6 | 1 minuto |
| EN1276 | P.aeruginosa | > log 7 | 1 minuto | EN13704 | B.subtilis | > log 6 | 1 minuto |
| EN1276 | E.coli | > log 7 | 1 minuto | EN13704 | B.pumilis | > 3,88 | 1 minuto |
| EN14476 | Poliovírus | 4,33 | 30seg | EN13704 | B.cereus | > 3,24 | 1 minuto |
| EN14476 | Adenovírus | 4,67 | 30seg | EN13704 | P.glycolyticus | > 3,12 | 1 minuto |
| EN1650 | A.niger | > log 6 | 1 minuto | EN13697 | B.subtilis (aço inoxidável) | > log 6 | 1 minuto |
Se a ciência estiver correta, este produto deve ser mais eficaz e de ação mais rápida que o produto equivalente de hipoclorito de sódio. A Tabela 1 mostra um resumo desses resultados para uma solução de cloro ativo de 2000 ppm. A morte completa contra esporos foi alcançada em condições limpas e sujas contra testes de superfície modificados em um minuto. Este é um aumento significativo quando comparado ao hipoclorito de sódio, tanto na redução logarítmica quanto na taxa de morte.
Vários microrganismos foram testados, incluindo um isolado específico de casa resistente que foi “tipificado” como P. glycolyticus . O trabalho de teste também foi repetido contra a versão mais recente da EN 16506 para fungos e fungos, que exige que mais de 75% dos esporos de A. niger (agora A. brasiliensis ) estejam na forma de “esporos espinhosos”, que são mais resistente.
Devido ao seu baixo pH e à concentração de cloro disponível, o produto também não apresenta riscos e, portanto, não requer EPI especializado ou consideração de descarte. É não corrosivo e os testes atuais mostram boa compatibilidade com os materiais das salas limpas.
Embora não seja isento de resíduos, porque uma pequena quantidade de sal residual de cálcio permanecerá, ele é lavado gratuitamente e está presente em níveis muito baixos. Um resíduo no resultado da evaporação (EP) deu 1200ppm por ml em comparação com 4500ppm para um quat ou 21.368ppm para hipoclorito de sódio.
Portanto, as evidências e os dados sugerem que o ácido hipocloroso estabilizado preenche a maioria, se não todos, os requisitos funcionais desinfetantes ideais. Quando fabricados por uma empresa com 25 anos de experiência na fabricação de produtos para a indústria farmacêutica, os aspectos de embalagem, fabricação e qualidade do desinfetante ideal também são atendidos.













